
开云体育登录官网:
摘要:本文主要讲解了凝胶过滤色谱法(分子筛)在蛋白纯化实验中的应用,包括纯化原理、实验方案设计、技术操作和相关案例介绍和问题分析。
凝胶过滤色谱蛋白纯化法,又称为空间排阻色谱,分子筛等。其原理是应用蛋白质分子量或分子形状的差异来分离。当样品从色谱柱的顶端向下运动时,大的蛋白质分子不能进入凝胶颗粒从而被迅速洗脱;而较小的蛋白质分子能够进入凝胶颗粒中,且进入凝胶的蛋白在凝胶中保留时间也不同,分子量越大,流出时间就越早,最终分离分子大小不同的蛋白质。
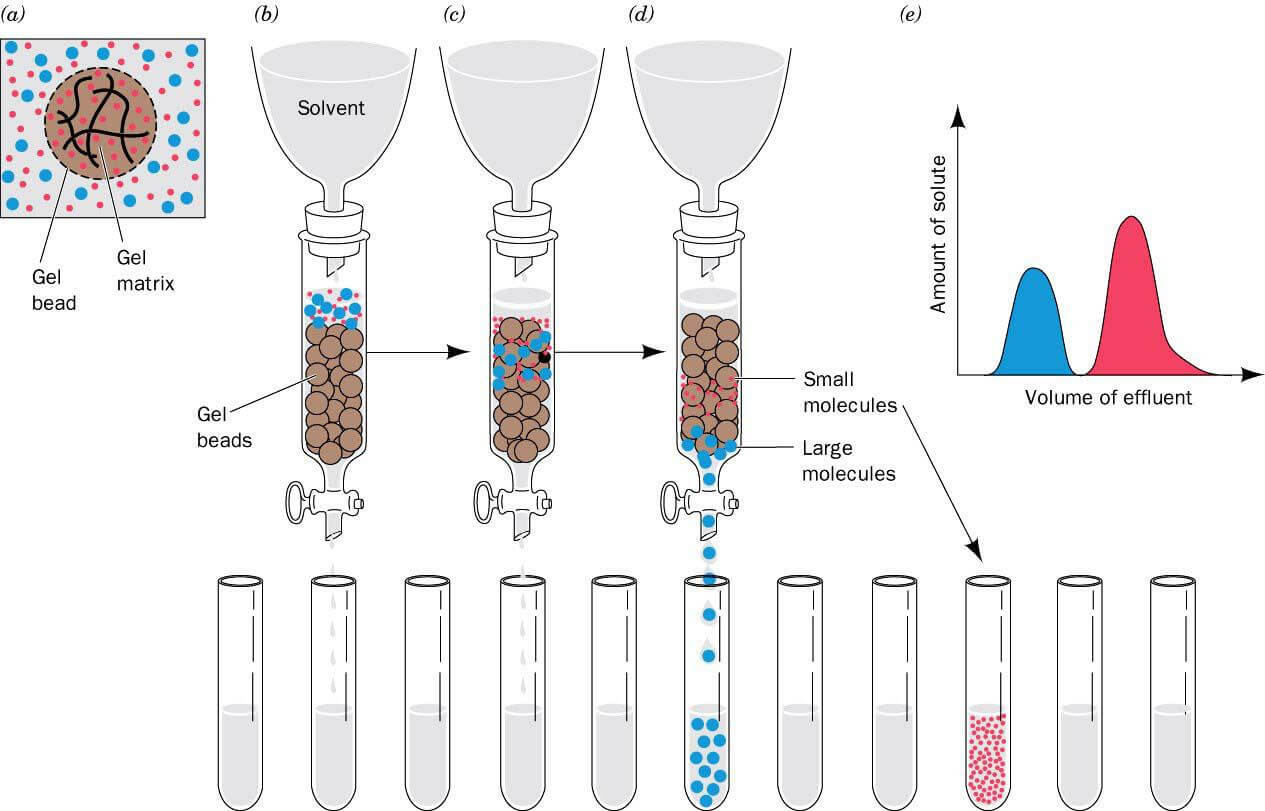
通常,多数凝胶基质是化学交联的聚合物分子制备的,交联程度决定凝胶颗粒的孔径。常用的色谱基质有:葡聚糖凝胶(Sephadex)、琼脂糖凝胶(Sepharose)、聚丙烯酰氨凝胶(Bio-Gel P)等。高度交联的基质可用来分离蛋白质和其他分子量更小的分子,或是除去低分子量缓冲液成分和盐,而较大孔径的凝胶可用于蛋白质分子之间的分离。选用合适孔径的凝胶很大程度取决于目标蛋白的分子量和杂蛋白的分子量。
凝胶介质的选择主要是根据待分离的蛋白和杂蛋白的分子量选择拥有相对应分离范围的凝胶,同时还需要考虑到分辨率和稳定能力的因素。比如,如果是要将目的蛋白和小分子物质分开,能够准确的通过他们分配系数的差异,选用Sephadex G-25和 G-50;对于小肽和低分子量物质的脱盐,则能选用Sephadex G-10、G-15以及Bio-Gel P-2或P-4;如果是分子量相近的蛋白质,一般都会采用排阻限度略大于样品中最高分子量物质的凝胶。具体凝胶过滤色谱介质应用如下:
色谱柱的体积和高径比与色谱分离效果紧密关联,凝胶柱床的体积、柱长和柱的直径以及柱比的选择必须根据样品的数量,性质和分离目的进行确定。组别分离时,大多采用2~30cm长的色谱柱,柱床体积为样品溶液体积的5倍以上,柱比一般在5~10之间;而分级分离通常要100cm左右的色谱柱,并要求柱床体积大于样品体积25倍以上,柱比在20~100之间。
凝胶色谱柱与其它色谱方法不同,溶质分子与固定相之间没有力的作用,样品组分的分离完全依赖于他们各自的流速差异。装住时关住柱子下口,在柱内加入约1/3柱床体积的水或缓冲液,然后沿着柱子一侧将缓冲液中的凝胶均匀搅拌,缓慢并连续的一次性注入柱内。待凝胶沉积约5厘米左右时,打开柱子下口,控制流速在1ml/min。
根据样品的类型和纯化分析,要选择合适的缓冲液,为了达到良好的分析效果,上样量一定要保持在较小的体积,一般为柱床体积的1%~5%,蛋白质样品上样前应进行浓缩,使样品浓度不大于4%(样品浓度与分配系数无关),但必须要格外注意的是,较大分子量的物质,溶液粘度会随浓度增加而增大,使分子运动受限,影响流速。上样前,样品要经滤膜过滤或离心,除去可能堵塞色谱柱的杂质。
凝胶过滤色谱的缓冲液用单一缓冲液或含盐缓冲液作为洗脱液即可,主要考虑俩个方面的原因:蛋白的溶解性和稳定能力。所用的缓冲液要保证蛋白质样品在其中不会变性或沉淀,PH应选在样品较稳定、溶解性良好的范围以内,同时缓冲液中要含有一定的盐(NaCL),对蛋白质起稳定和保护作用。洗脱过程中从始至终保持一定的操作压,流速不可过高,保持在0.5~3.0mL/min即可。
混合样品:含单克隆抗体,分子量180000;牛血清白蛋白(68000),溶菌酶(14000)
凝胶除菌处理:超纯水冲洗柱子后,用0.5mol/L NaOH正向冲洗柱,流速3mL/min,冲洗3柱体积
平衡:NaOH处理完毕后,用超纯水冲洗2柱体积,接着用含200mmol/L NaCl和20mmol/L PB的7.0PH缓冲液冲洗5~10倍柱体积
上样:平衡完毕后,选择样品泵进行上样,上样流速3mL/min,上样体积为1mL
纯化结束后,用0.5mol/L NaOH反向冲洗2柱体积,冲洗时间30~60min,冲洗结束后,用超纯水正向冲洗5柱体积,再用20%乙醇冲洗3柱体积,然后拆下柱子,两端封死,低温保存。
在色谱分离前,对样品进行离心和过滤,离心能除去大部分块状物,如果离心后样品仍不清澈,可用滤膜过滤。由醋酸纤维薄膜或PVDF材料制造成的滤膜能够非特异性的结合少量蛋白。
若样品溶液体积较多,可以分多次上样,注意每次上样时间间隔,可根据电导色谱峰确定下一次上样时间。
1)提高装柱质量,装柱匀实——若柱装的太松,会造成拖尾,装的太紧,会引起前沿;
请选择鼠单抗制备服务兔单抗制备服务羊驼VHH制备服务杂交瘤抗体基因测序服务重组蛋白表达服务重组抗体表达服务磷酸化抗体制备服务小分子抗体制备服务抗体人源化服务其他服务产品